- Noticias / Mecanismos epigenéticos regulan la arquitectura 3D del genoma en el parásito que causa la tricomoniasis
Mecanismos epigenéticos regulan la arquitectura 3D del genoma en el parásito que causa la tricomoniasis
Compartir en
redes sociales
En un estudio realizado en el Instituto Tecnológico Chascomús (INTECH, CONICET-UNSAM) en colaboración con investigadores de Estados Unidos (Harvard Medical School y University of California Los Angeles) y recientemente publicado en la prestigiosa revista Proceedings of the National Academy of Sciences (PNAS), demuestran por primera vez que la epigenética tiene influencia en la estructura tridimensional del genoma para generar bloques transcripcionales en el parásito Trichomonas vaginalis.
La tricomoniasis, causada por el parásito Trichomonas vaginalis, es una de las infecciones de transmisión sexual no viral más comunes del mundo con un estimado de 156 millones de personas infectadas cada año. Es una enfermedad que afecta tanto a hombres como a mujeres. Es un mal incómodo, ya que en las mujeres produce inflamación vaginal, comezón y un flujo amarillento con un olor característico. En los hombres generalmente no presentan signos ni síntomas. Si no es tratada, la tricomoniasis puede presentar complicaciones asociadas tales como embarazos de alto riesgo debido a parto prematuro, infertilidad en hombres y mujeres, mayor susceptibilidad a la infección por el virus de HIV y recientemente ha sido también asociada a una mayor predisposición al cáncer cervical o prostático. A pesar de la importancia de esta enfermedad y sus complicaciones asociadas, la tricomoniasis no es una enfermedad muy conocida o publicitada y los mecanismos que utiliza el parásito para desarrollar la infección son aún desconocidos.
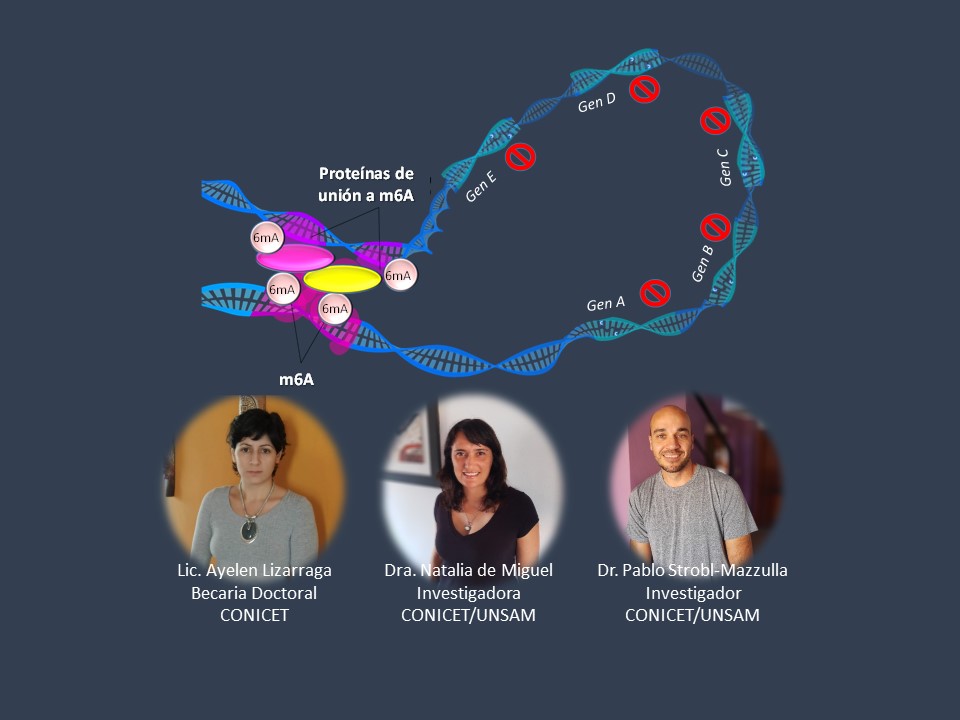
Se cree que las diferencias sintomatológicas asociadas a la infección podrían deberse, al menos en parte, a la existencia diferentes cepas de T. vaginalis que poseen fenotipos claramente variables en cuanto a su capacidad de causar daño a la células del hospedador. Estas diferencias fenotípicas sugieren que, aun cuando las cepas poseen secuencias de ADN prácticamente idénticas, la expresión de genes claves se encuentra regulada diferencialmente, por ejemplo por modificaciones epigenéticas. Hoy en día se sabe que estas modificaciones, como son la metilación (es decir, el agregado de grupos metilo en nucleótidos específicos) del ADN, son necesarias para el desarrollo normal de los distintos tipos de células. Sin embargo, hasta el momento no se había estudiado la importancia de esta modificación en T. vaginalis, explica la Dra. Natalia de Miguel, investigadora independiente del CONICET en el INTECH y directora del trabajo recientemente publicado. Específicamente, el estudio realizado demuestra que T. vaginalis posee altos niveles de metilación en adeninas (6mA); siendo uno de los pocos organismos eucariotas en donde se ha identificado altos niveles de esta modificación en su ADN. El análisis de la distribución de esta marca en el genoma reveló que 6mA tiene preferencia por regiones intergénicas. Lo más novedoso del trabajo es que observaron que la presencia de estas marcas delimitaba regiones del genoma que contenían genes con niveles de expresión similares. Es decir que estas zonas ricas en 6mA eran capaces de establecer estructuras tridimensionales del ADN en donde los genes contenidos tenían un estado “ON” o “OFF”. “La asociación de 6mA con la formación de este tipo de estructuras tridimensionales no había sido descripta previamente en ningún otro organismo o tipo celular” explica el Dr. Strobl-Mazzulla, colaborador en este trabajo.
“Comprender los mecanismos epigenéticos que regulan la expresión de genes importantes en el proceso de patogénesis y cómo estos mecanismos podrían variar entre cepas tendría una gran relevancia para comprender la etiología de esta infección tan prevalente, así como también sentar las bases para el desarrollo de posibles blancos terapéuticos” comenta la Lic. Ayelen Lizarraga, primera autora de este trabajo.