- Biología del Desarrollo
- Bioquímica y Biología Celular de Parásitos
- Bioquímica y Fisiología de la Maduración de Frutos
- Biotecnologías en Bovinos y Ovinos
- Células Madre y Terapia Génica
- Ecología Acuática
- Ecología Microbiana Ambiental
- Estrés Abiótico y Biótico en Plantas
- Fisiología y Asistencia al Mejoramiento Vegetal
- Fisiología de Plantas
- Fitobacteriología
- Fotoquímica y Fotobiología Molecular
- Ictiofisiología y Acuicultura
- Interacciones planta-microorganismos
- Micología y Cultivo de Hongos Comestibles y Medicinales
- Microbiología del Suelo
- Molecular Farming y Vacunas
- Neuroendocrinología Comparada
- Parasitología Molecular
- Parásitos Anaerobios
Laboratorio de Biología del Desarrollo
Directores
- Dr. Juan Ignacio Fernandino - Investigador Independiente CONICET. Profesor Adjunto UNSAM fernandino@intech.gov.ar

- Dr. Pablo Hernán Strobl-Mazzulla - Investigador Independiente CONICET. Profesor Adjunto UNSAM strobl@intech.gov.ar
Becarios

- Ing. en Agrob. Agustín F. Boan - Becario Doctoral CONICET aboan@intech.gov.ar

- Lic. en Biotec. y Biol. Molec. Natalia Pagliaro - Becaria Doctoral CONICET npagliaro@intech.gov.ar

- Lic. Luciana Ailín Scatturice - Becaria Doctoral ANPCyT lascatturice@intech.gov.ar

- Lic. Gen. Rocío Belén Marquez - Becaria Doctoral ANPCyT rmarquez@intech.gov.ar

- Lic. en Biot. Angela Celeste Urquizo Rosado - Becaria Doctoral ANPCyT aurquizo@intech.gov.ar
Personal de Apoyo

- Agustina Ganuza - Técnica CIC agusganuza@intech.gov.ar
Líneas de Investigación
Control epigenético de la especificación y diferenciación celular durante el desarrollo en vertebrados
El principal blanco de estudio de nuestro laboratorio es el de comprender la base epigenética que regula el desarrollo y la diferenciación celular en vertebrados. Aunque cada célula de un organismo multicelular proviene de una única célula y por lo tanto todas ellas comparten la misma información en su ADN, las células son capaces de diferenciarse a formas 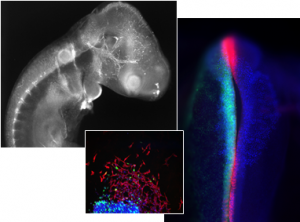 especializadas muy diversas. Estas células al especializarse activan mecanismos regulatorios, que no implican cambios en la secuencia de ADN, los cuales pueden ser heredados por las células hijas durante el proceso de diferenciación. A este proceso se lo conoce como “epigenética” y el entendimiento de dicho fenómeno es el motivo de nuestra investigación. Este conocimiento tiene grandes implicancias en la comprensión de un gran número de enfermedades durante el desarrollo embrionario, ya que la transmisión anómala de dicha información epigenética contribuye en un gran número de enfermedades en humanos, tales como cáncer, enfermedades degenerativas, defectos en el desarrollo y retrasos mentales entre otras.
especializadas muy diversas. Estas células al especializarse activan mecanismos regulatorios, que no implican cambios en la secuencia de ADN, los cuales pueden ser heredados por las células hijas durante el proceso de diferenciación. A este proceso se lo conoce como “epigenética” y el entendimiento de dicho fenómeno es el motivo de nuestra investigación. Este conocimiento tiene grandes implicancias en la comprensión de un gran número de enfermedades durante el desarrollo embrionario, ya que la transmisión anómala de dicha información epigenética contribuye en un gran número de enfermedades en humanos, tales como cáncer, enfermedades degenerativas, defectos en el desarrollo y retrasos mentales entre otras.
Las células de la cresta neural (CCN) son un grupo de células multipotentes que se originan en la parte más dorsal del tubo neural, y previo al cierre del mismo son capaces de delaminar de dicho epitelio adquiriendo capacidad migratoria. Después de migrar y alcanzar su destino, las CCN se diferencian en un gran número de derivados celulares, incluyendo neuronas, glía, melanocitos, osteocitos y condrocitos, y así formar parte de diversos tejidos. Para adquirir capacidad migratoria, estas células tienen que delaminar del neuroepitelio mediante un proceso conocido como transición epitelio-mesénquima (TEM), y de manera opuesta, al condensarse y diferenciarse para formar ciertos tejidos sufren una transición mesénquima-epitelio (TME). Ambos procesos, llevados a cabo por las CCN, tienen grandes semejanzas en cuanto a las vías moleculares que se activan y a los cambios celulares que sufren las células cancerosas durante el inicio de la metástasis y el establecimiento de tumores secundarios. En los últimos años se ha demostrado la existencia de redes regulatorias epigenético-microRNAs que regulan los procesos de TEM en células cancerosas. Particularmente, se ha demostrado la existencia de un proceso dinámico y reversible de metilación-demetilación del ADN de determinados microARNs antitumorales involucrados en la regulación de genes implicados en dichas transiciones. Sin embargo, cabe destacar que el estudio de la TME de células cancerosas in vivo resulta muy complejo dada la impredecibilidad del tejido en donde se establecerán los tumores secundarios. En este sentido nosotros hipotetizamos la existencia de redes regulatorias epigenético-microRNA comunes entre las CCN y a las células tumorales durante ambas transiciones. Sobre esta premisa, el objetivo general de este proyecto es determinar la existencia de una red regulatoria reversible entre factores epigenéticos y microARNs necesarios para la delaminación y condensación de las CCN en vertebrados.
Durante el desarrollo del embrión, los diferentes programas de diferenciación celular son controlados estrictamente. Al momento de la gastrulación, las células ectodérmicas comienzan a segregarse en dos territorios bien definidos, la placa neural y el borde de la placa neural (cresta neural y progenitores de placoda), mediante una compleja red secuencial de genes. Los miRNA son un subgrupo específico de RNAs no codificantes que están implicados en una gran cantidad de eventos celulares, incluido el equilibrio entre la proliferación y la diferenciación, así como también son capaces de la modulación espacio-temporal de genes importantes en el desarrollo temprano. Es bien sabido que la suplementación con vitaminas es necesaria durante los períodos periconcepcionales en humanos. Particularmente, el folato y la vitamina C (ácido ascórbico) son requeridos para los procesos de metilación y demetilación del ADN, respectivamente. Aproximadamente el 50% de los miARN están inmersos o asociados a islas CpG, y su expresión está regulada principalmente por metilación del ADN. En este sentido, en nuestro grupo estamos estudiando el rol de la vitamina C y la disponibilidad de folato en la regulación epigenética de microARN involucrados en la restricción territorial de los progenitores de las placas neurales y neurales.
El folato es un compuesto esencial para el desarrollo embrionario temprano. Los humanos son incapaces de sintetizar folato; por lo tanto, debe incorporarlo por la dieta para satisfacer sus necesidades metabólicas. La deficiencia de folato o la exposición a alcohol en las primeras etapas del desarrollo conduce a defectos graves del tubo neural y de la cresta neural, tales como espina bífida, trastornos craneofaciales y cardíacos. Aunque tanto la deficiencia de folato como la toxicidad del alcohol en las primeras etapas de desarrollo han siempre sido atribuidas a la exposición materna, estudios recientes en modelos humanos y animales han sugerido que los padres pueden contribuir a dichas anomalías. Estudios muy recientes demostraron que la descendencia puede heredar ciertos rasgos paternos, lo que sugiere que la herencia epigenética puede ocurrir a través de los espermatozoides. En la búsqueda de estos «factores lamarckianos» en los espermatozoides se ha sugerido recientemente que los ARNs y sus modificaciones, en particular en los ARN pequeños no codificantes (sncARN), podrían ser los mediadores de esta herencia. Además se ha demostrado que estos sncRNA pueden regular en última instancia la metilación del ADN, las modificaciones de histonas y la traducción de ARNm y por lo tanto afectar el desarrollo temprano. Bajo este marco, en nuestro laboratorio estamos estudiando el efecto paterno de la exposición al alcohol y la deficiencia de folato sobre las desregulaciones de las modificaciones y el contenido de sncRNA en el esperma que pueden producir defectos de desarrollo de la descendencia.
Control molecular de la organogénesis gonadal en vertebrados
El proceso de desarrollo morfológico de la gónada a partir de un primordio bipotencial es un paso crítico en la gonadogénesis para el establecimiento del sexo biológico. Cuando se diferencia, la gónada puede convertirse 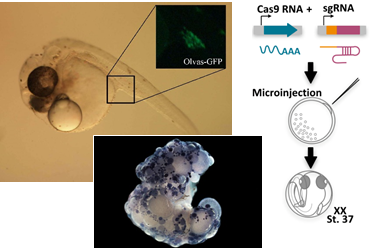 en un ovario o bien en un testículo, y cualquier desvío, tanto molecular como endócrino, por lo general producen una inversión de sexo o incluso la esterilidad del individuo. Por lo tanto, el desarrollo gonadal sirve como un excelente sistema modelo para investigar cuestiones de destino celular y de organogénesis. Particularmente nos enfocamos en la cadena de diferenciación molecular que lleva al desarrollo morfológico de una gónada funcional y como estos genes son regulados por hormonas.
en un ovario o bien en un testículo, y cualquier desvío, tanto molecular como endócrino, por lo general producen una inversión de sexo o incluso la esterilidad del individuo. Por lo tanto, el desarrollo gonadal sirve como un excelente sistema modelo para investigar cuestiones de destino celular y de organogénesis. Particularmente nos enfocamos en la cadena de diferenciación molecular que lleva al desarrollo morfológico de una gónada funcional y como estos genes son regulados por hormonas.
La regulación de la proliferación de las células germinales es un proceso fundamental para la diferenciación de las gónadas así como la reproducción de cualquier especie. Está regulación es llevada a cabo por el balance óptimo entre la proliferación, necesaria para la producción de un número adecuado de gametas, y la apoptosis o muerte celular programada, necesaria para la eliminación de gametas defectuosas y el control de la proliferación. La pérdida de este balance puede producir la hiper-proliferación de las células germinales, produciendo neoplasias o cáncer testiculares u ováricos, o por otro lado un exceso en la apoptosis llevaría a la esterilidad del individuo. Este balance está regulado a nivel endócrino y molecular. Es por esto que nos interesa conocer los mecanismos moleculares, epigenéticos y endócrinos que regulan este proceso fundamental para el éxito reproductivo.
Estudios recientes revelan la existencia de un posible mecanismo de regulación cruzada entre HPT y HPG, donde por ejemplo las hormonas tiroideas (HTs) regularían positivamente en concentraciones ambientalmente relevantes la síntesis de andrógenos en la masculinización observada en peces y ranas expuestas a estas hormonas. Pretendemos determinar los efectos de las HTs en el desarrollo gonadal de dos modelos de vertebrados acuáticos: Oryzias latipes y Silurana tropicalis, para dilucidar los mecanismos moleculares implicados en esta regulación cruzada. Con el presente proyecto se conocerá la regulación de HTs en la síntesis de andrógenos en un proceso clave del desarrollo, como es la diferenciación gonadal estableciendo una interesante propuesta molecular y endocrinológica comparada.
Publicaciones
Bernardi YE, Sanchez-Vasquez E, Márquez RB, Piacentino ML, Urrutia H, Rossi I, Alcântara Saraiva KL, Pereira-Neves A, Ramirez MI, Bronner ME, de Miguel N, Strobl- Mazzulla PH. miR-203 secreted in extracellular vesicles mediates the communication between neural crest and placode cells required for trigeminal ganglia formation. Plos Biology. En prensa. https://doi.org/10.1371/journal.pbio.3002074
Boan AF, Delgadin TH, Canosa LF, Fernandino JI. Loss of function in somatostatin receptor 5 has no impact on the growth of medaka fish due to compensation by the other paralogs. General and Comparative Endocrinology 351, 114478. 2024. https://doi.org/10.1016/j.ygcen.2024.114478
Lopez-Landavery EA, Urquizo-Rosado Á, Saavedra-Flores A, Tapia-Morales S, Fernandino JI, Zelada-Mázmela E. Cellular and transcriptomic response to pathogenic and non-pathogenic Vibrio parahaemolyticus strains causing acute hepatopancreatic necrosis disease (AHPND) in Litopenaeus vannamei. Fish and Shellfish Immunology 148, 109472. 2024. https://doi.org/10.1016/j.fsi.2024.109472
Sacatturice LA, Vázquez N, Strobl-Mazzulla PH. miR-137 conferred robustness to the territorial restriction of the neural plate border. Development. En prensa. https://doi.org/10.1242/dev.202344
Torres-Martínez A, Hattori RS, Fernandino JI, Somoza MG, Hung SD, Yamamoto Y, Strüssmann CA. Temperature- and genotype-dependent stress response and activation of the hypothalamus-pituitary-interrenal axis during temperature-induced sex reversal in pejerrey Odontesthes bonariensis, a species with genotypic and environmental sex determination. Molecular and Celular Endocrinology 582, 112114. 2024. doi:10.1016/j.mce.2023.112114
Alata Jimenez NA, Casterllano M, Santillan EM, Boulias K, Boan A, Padilla LF, Fernandino JI, Greer EL, Tosar JP, Cochella L, Strobl-Mazzulla PH. Paternal methotrexate exposure affects sperm small RNA content and causes craniofacial defects in the offspring. Nature Communications 14, 1617. 2023. https://doi.org/10.1038/s41467-023-37427-7
Carriquiriborde P, Fernandino JI, López CG, de San Benito E, Gutierrez-Villagomez JM, Cristos D, Trudeay VL, Somoza GM. Atrazine alters early sexual development of the South American silverside, Odontesthes bonariensis. Aquatic Toxicology 254, 106366. 2023. doi: doi:10.1016/j.aquatox.2022.106366
Castañeda-Cortés DC, Rosa IF, Boan AF, Marrone D, Pagliaro N, Oliveira MA, Rodrigues MS, Doretto LB, Silva C, Tavares-Júnior J, Costa DF, Dodds MS, Strobl-Mazzulla PH, Langlois VS, Nóbrega RH, Fernandino JI. Thyroid axis participates in high-temperature-induced male sex reversal through its activation by the stress response. Cellular and Molecular Life Sciences 80, 253. 2023. https://doi.org/10.1007/s00018-023-04913-6
Marín A, Alonso AM, Delgadín TH, López-Landavery EA, Lise J.A.R.A. Cometivos, Saavedra-Flores A, Reyes-Flores LE, Yzásiga-Barrera C, Fernandino JI, Zelada-Mázmela E. Analysis of truncated growth hormone receptor 1 in the differential growth of fine flounder Paralichthys adspersus. Aquaculture 574, 739691. 2023. https://doi.org/10.1016/j.aquaculture.2023.739691
Moreno Acosta OD, Boan AF, Hattori RS, Fernandino JI. Notch pathway is required for protection against heat stress in spermatogonial stem cells in medaka. Fish Physiology and Biochemistry 49, 487-500. 2023. https://doi.org/10.1007/s10695-023-01200-w
Alata Jimenez N, Strobl-Mazzulla P. Folate carrier deficiency drives differential methylation and enhanced cellular potency in the neural plate border. Frontiers in Cell and Developmental Biology 10, 834625.2022. https://doi.org/10.3389/fcell.2022.834625
Delbes G, Blázquez M, Fernandino JI, Grigorova P, Hales BF, Metcalfe C, Navarro-Martín L, Parent L, Robaire B, Rwigemera A, Van Der Kraak G, Wade M, Marlatt V. Effects of endocrine disrupting chemicals on gonad development: Mechanistic insights from fish and mammals. Environmental Research 204B, 112040. 2022. https://doi.org/10.1016/
Goikoetxea A, Servill A, Houdelet C, Mouchel O, Hermet S, Clota F, Aerts J, Fernandino JI, Allal F, Vandeputte, Blondeau‑Bidet E, Geffroy B. Natural cortisol production is not linked to the sexual fate of European sea bass. Fish Physiol Biochem 48, 1117-1135. 2022. https://doi.org/10.1007/
López-Landavery EA, Corona-Herrera GA, Santos-Rojas LE, Herrera-Castilo NM, Delgadin TH, Tapia-Morales S, González-Martínez S, Reyes–Flores LE, Marín A, Yzásiga–Barrera CG, Fernandino JI, Zelada–Mázmela E. Non-invasive sex genotyping of paiche Arapaima gigas by qPCR: An applied bioinformatic approach for identifying sex differences. Aquaculture 546, 737388 2022. https://doi.org/10.1016/
Arias Padilla LF, Castañeda-Cortés DC, Rosa IF, Moreno Acosta OD, Hattori RS, Nóbrega RH, Fernandino JI. Cystic proliferation of germline stem cells is necessary to reproductive success and normal mating behavior in medaka. Elife 10, e62757.2021. https://doi.org/10.7554/eLife.62757
Bernardi Y, Strobl-Mazzulla PH. What we can learn from embryos to understand the mesenchymal-to-epithelial transition in tumor progression. Biochemical Journal 478, 1809-1825. 2021. https://doi.org/10.1042/BCJ20210083
Butzge AJ, Yoshinaga TT, Moreno Acosta OD, Fernandino JI, Sanches EA, Tabata YA, de Oliveira C, Takahashi NS, Hattori RS. Early warming stress on rainbow trout juveniles impairs male reproduction but contrastingly elicits intergenerational thermotolerance. Scientifc Reports 11, 17053. 2021. https://doi.org/10.1038/s41598-021-96514-1.
Castañeda-Cortés DC, Fernandino JI. Stress and sex determination in fish: From brain to gonads. The International Journal of Developmental Biology 65, 207-214. 2021. https://doi:10.1387/ijdb.200072jf
Lizarraga A, Muñoz D, Strobl-Mazzulla PH, de Miguel, N. Toward incorporating epigenetics into regulation of gene expression in the parasite Trichomonas vaginalis. Molecular Microbiology 115: 959–967. 2021. https://doi.org/10.1111/mmi.14704
Marín A, López–Landavery E, González–Martinez S, Reyes-Flores L, Corona-Herrera G, Tapia-Morales S, Yzásiga-Barrera C, Fernandino JI, Zelada-Mázmela E. The complete mitochondrial genome of the fine flounder Paralichthys adspersus revealed by next-generation sequencing. Mitochondrial DNA Part B 6, 2785-2787. 2021. https://doi.org/10.1080/
Strüssmann CA, Yamamoto Y, Hattori RS, Fernandino JI, Somoza GM. Where the ends meet: an overview of sex determination in atheriniform fishes. Sexual Development. On-line. https://doi.org/10.1159/000515191
Castañeda-Cortés DC, Zhang J, Boan A, Langlois VS, Fernandino JI. High temperature stress response is not sexually dimorphic at the whole-body level and is dependent on androgens to induce sex reversal. General and Comparative Endocrinology. 299,113605. 2020. https://doi.org/10.1016/j.ygcen.2020.113605
Delgadin TH, Castañeda-Cortés DC, Sacks C, Breccia A, Fernandino JI, Vissio PG. Morphological colour adaptation during development: Involvement of Growth Hormone Receptor 1. Journal of Experimental Biology. 223. 2020. https://doi:10.1242/jeb.230375
González A, Kroll KJ, Silva-Sánchez C, Carriquiriborde P, Fernandino JI, Denslow ND, Somoza GM. Steroid hormones and estrogenic activity in the wastewater outfall and receiving waters of the Chascomús chained shallow lakes system (Argentina). Sci Total Environ 743: 140401. 2020. https://doi.org/10.1016/j.scitotenv.2020.140401
Hattori RS, Castañeda-Cortés DC, Arias Padilla LF, Strobl-Mazzulla PH, Fernandino, JI.Activation of stress response axis as a key process in environment-induced sex plasticity in fish. Cellular and Molecular Life Sciences 77, 4223-4236. 2020 https://doi.org/10.1007/s00018-020-03532-9
Lizarraga A, Klapholz O’Brown Z, Boulias K, Roach L, Greer E, Johnson PJ, Strobl-Mazzulla, PH, de Miguel N. Adenine DNA methylation, 3D genome organization and gene expression in the parasite Trichomonas vaginalis. Proceedings of the National Academy Sciences of the United States of América 117, 13033-13043.2020 https://doi.org/10.1073/pnas.1917286117
Castañeda Cortés DC, Arias Padilla LF, Langlois VS, Somoza GM, Fernandino JI. The central nervous system acts as a transducer of stress-induced masculinization through corticotropin-releasing hormone B. Development. 146: dev172866. 2019. https://doi.org/10.1242/dev.172866
Fernandino JI, Hattori RS. Sex determination in Neotropical fish: Implications ranging from aquaculture technology to ecological assessment. 2019. Gen Comp Endocrinol. 273: 172-183. 2019. https://doi.org/10.1016/j.ygcen.2018.07.002
González A, Fernandino JI, Elisio M, Chalde T, Miranda LA, Hammond GL, Somoza GM. Sex hormone binding globulin during an annual reproductive cycle in the hepatopancreas and ovary of pejerrey (Odontesthes bonariensis). Gen Comp Endocrinol. 272: 52-56. 2019. https://doi.org/10.1016/j.ygcen.2018.11.010
Hattori RS, Somoza GM, Fernandino JI, Colautti DC, Miyoshi K, Gong Z, Yamamoto Y, Strüssmann CA. The duplicated Y-specific amhy gene is conserved and linked to maleness in silversides of the genus Odontesthes. Genes (Basel). 10: 679. 2019. https://doi.org/10.3390/genes10090679
Sánchez-Vásquez E, Bronner ME, Strobl-Mazzulla PH. Epigenetic inactivation of miR-203 as a key step in neural crest epithelial-to-mesenchymal transition. Development. 146: dev171017. 2019. https://doi.org/10.1242/dev.171017


